|
Vesi on väga hea lahusti. Suuremal või vähemal määral lahustub
selles enamik looduslikke aineid – nii õhu koostises olevad
gaasid kui ka maapinnas leiduvad mitmesugused soolad ning teised ained. Seetõttu ei ole
ka looduses kunagi täiesti puhast vett. Kõige
puhtam looduslik vesi on vihmavesi. Tavalises kaevu- või veevärgivees, eriti aga merevees, on lahustunud märgatavas koguses erinevaid sooli.
Levinuimad
loodusliku vee lisandid on naatriumi-, kaaliumi-, kaltsiumi- ja magneesiumisoolad. Vees lahustunud kaltsiumi- ja
magneesiumisoolad põhjustavad vee karedust.
Kareda vee kuumutamisel või keetmisel
moodustub keedunõu põhja ning seintele krobeline ja kõva katlakivi kiht.
See tekib
vees lahustunud vesinikkarbonaatide – Ca(HCO3)2 ja
Mg(HCO3)2 – tõttu. Need lagunevad
kuumutamisel ning moodustavad
vees praktiliselt lahustumatud karbonaadid (CaCO3 ja
MgCO3), mis ongi katlakivi põhikoostisained.
Ca(HCO3)2 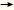 CaCO3
CaCO3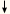 + CO2
+ CO2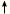 + H2O + H2O
Kareda vee kahjuliku toime vältimiseks on seda vaja eelnevalt pehmendada. Lihtsamaks vee pehmendamise mooduseks on
keetmine. Seejuures vesinikkarbonaadid lagunevad ning tekkinud karbonaadid sadenevad katlakivina välja. Kõigist
kaltsiumi- ja magneesiumiühenditest sel teel vabaneda ei õnnestu
(näiteks kloriididest ja sulfaatidest). Vee pehmendamiseks
rakendatakse ka teisi meetodeid.
Ca2+- ja Mg2+-ioonide sadestamiseks
kasutatakse pehmendajat
(näiteks Na3PO4). Selle lisamisel sadenevad
kaltsiumi- ja magneesiumifosfaadid ning katlakivi enam ei moodustu.
3Ca(HCO3)2 +
2Na3PO4 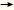 Ca3(PO4)2
Ca3(PO4)2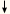 +
6NaHCO3
+
6NaHCO3
Tänapäeval on levinud ka vee pehmendamine ioniitide abil. Need on ained, mis on võimelised vahetama oma koostisse
kuuluvaid ioone lahuses olevate teiste ioonide vastu. Ioniite, mis on võimelised vahetama katioone, nimetatakse
kationiitideks. Need
seovad veest näiteks Ca2+- ja Mg2+-ioone,
asendades need kationiidi koostisse algselt kuuluvate H+-
või Na+-ioonidega.
H–R–H + Ca2+ 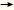 R=Ca + 2H+ (R tähistab
kationiiti)
R=Ca + 2H+ (R tähistab
kationiiti)
Lahuses esinevaid anioone seovad anioniidid. Need seovad veest näiteks HCO3-- ja SO42--ioone
asendades need anioniidi koostisse algselt kuuluvate OH--ioonidega.
Anioniitidega saab karedast veest
kõrvaldada näiteks HCO3-- ja SO42--ioone.
HO–R–OH + SO42-
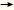 R=SO4 +
2OH- (R tähistab
anioniiti) R=SO4 +
2OH- (R tähistab
anioniiti)
|